聚合物纳米颗粒在诊疗一体化和纳米药物应用中显示出巨大的潜力。但是由于非特异性生物分子吸附、非特异性细胞摄取、过短的体内循环时间等因素的影响,这些纳米颗粒常常无法实现其设计的功能。多年来,研究人员通过控制纳米颗粒的物理化学参数(包括大小、形状、形态、表面电荷、亲水性、弹性、表面化学等)来克服这些障碍并提高聚合物纳米颗粒的性能。但迄今为止,鲜有基于一个纳米颗粒系统同时在分子、细胞和生物体层面上的纳米颗粒生物响应性的研究。
近日新加坡国立大学刘斌课题组在ACS Nano上发表了其关于聚合物纳米颗粒生物响应的机理研究。该课题组对聚合物纳米颗粒与胞质蛋白、上皮细胞和斑马鱼中的相互作用与生物学行为进行了表征。基于相关结果,课题组提出一个合理的框架来开发具有优化性能的聚合物纳米颗粒,以同时在分子、细胞和生物体水平上实现所需的功能。
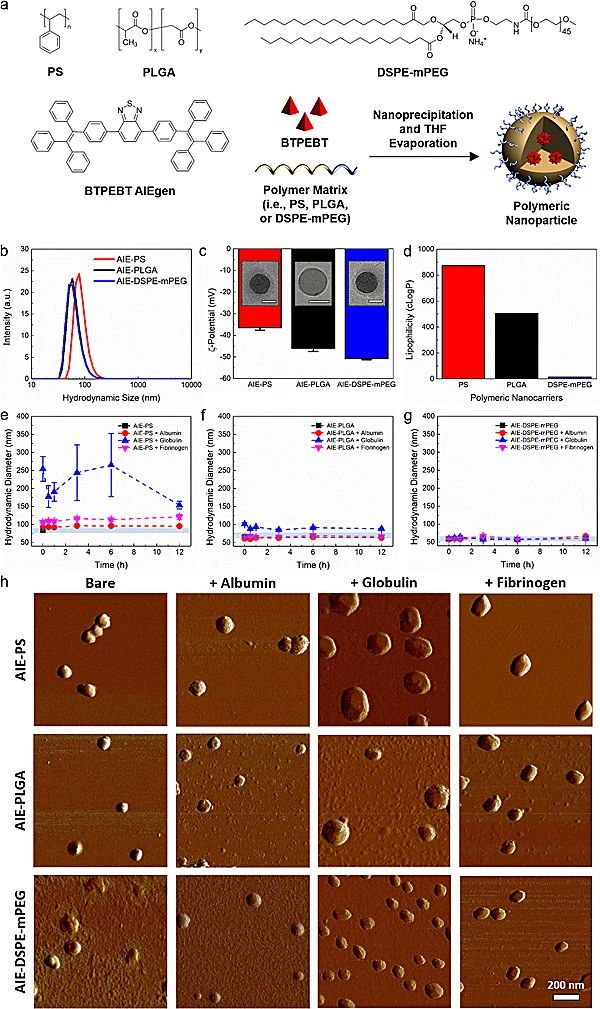
图1.包裹AIE分子的不同的聚合物纳米颗粒与三种主要的血浆蛋白的相互作用表征
该课题组使用三种不同的聚合物(聚苯乙烯PS、聚乳酸-羟基乙酸PLGA和脂质PEG衍生物DSPE-mPEG)包覆荧光AIE分子BTPEBT,制备得到三种直径约60 - 80 nm的纳米颗粒,并研究了纳米颗粒与三种主要的血浆蛋白(白蛋白、球蛋白和纤维蛋白原)的相互作用(图1)。结果表明随着时间增长,AIE-PS和AIE-PLGA的纳米颗粒与血浆蛋白产生了较强的相互作用,其流体力学直径有数倍的增加,而DSPE-mPEG纳米颗粒没有观察到其直径变化,这表明DSPE-PEG作为纳米颗粒载体时拥有最弱的纳米颗粒-蛋白相互作用(图2)。
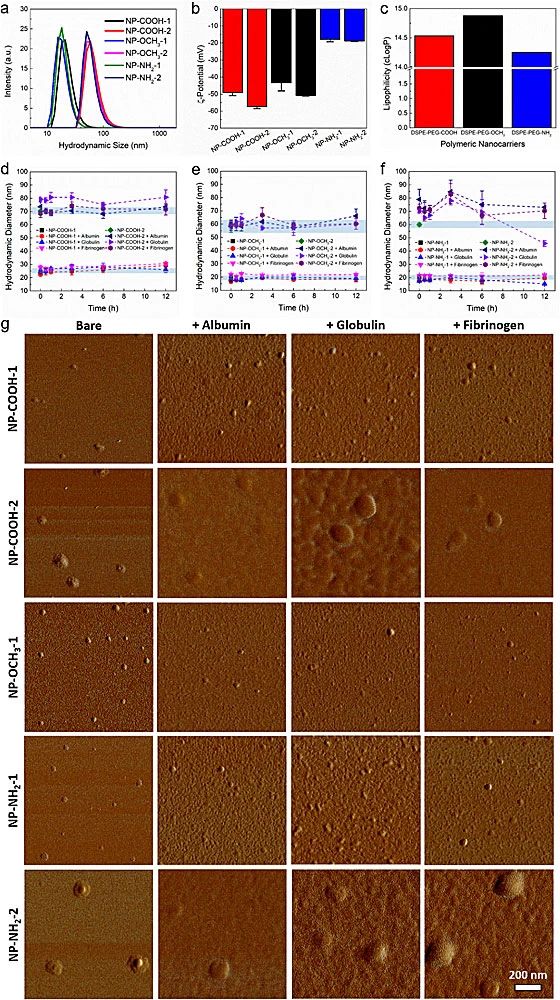
图2.不同表面官能团的AIE-DSPE-PEG纳米颗粒与三种血浆蛋白的相互作用表征
在发现AIE-DSPE-mPEG对血浆蛋白的惰性后,该课题组制备了两种尺寸(20 nm NP-1, 60 nm NP-2)、三种表面官能团(羧基-COOH、甲氧基-OCH3、氨基-NH2)共计六种纳米颗粒(图3)。表征结果,对于60 nm的纳米颗粒,只有球蛋白引起了NP-COOH-2粒径的略微增长;NP-OCH3-2与三种蛋白作用均无变化;而NP-NH2-2与三种蛋白作用均有较大的尺寸增加。有趣的是,在血浆蛋白存在下,所有NP-1的大小都不会随时间变化,这表明血浆蛋白没有吸附在20 nm聚合物纳米载体表面。
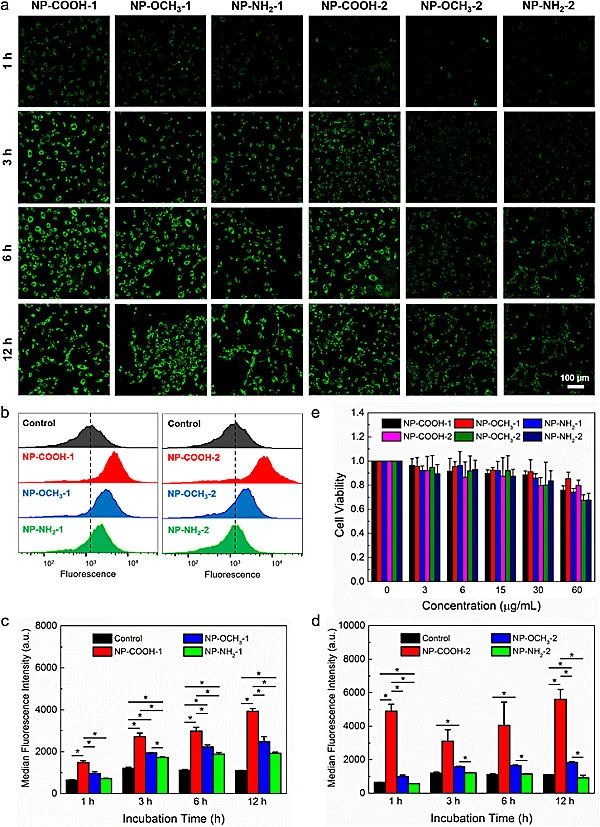
图3.不同纳米颗粒在人脐静脉内皮细胞(HUVEC)的细胞摄取与细胞毒性表征
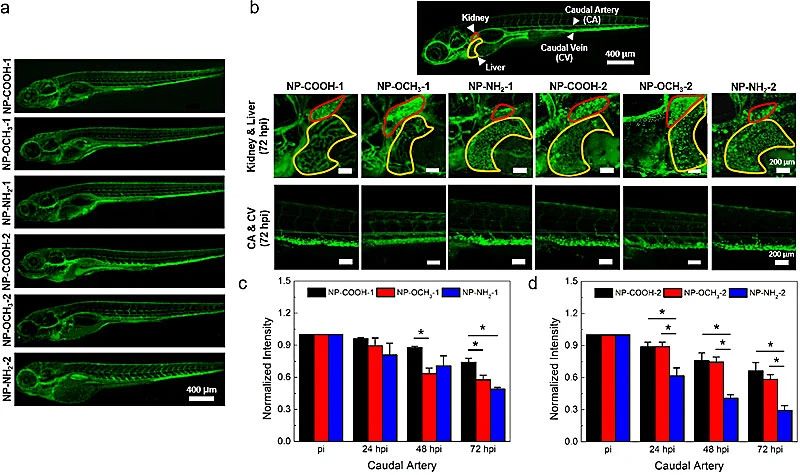
图4.斑马鱼体内聚合物纳米颗粒的体内循环和生物分布
随后课题组研究了纳米颗粒与人脐静脉内皮细胞(HUVEC)的细胞摄取与细胞毒性。共聚焦显微镜成像和流式细胞术结果表明HUVECs更容易摄取较小粒径的纳米颗粒。比较三种表面官能团,zeta电位最低的NP-COOH的纳米颗粒容易被细胞摄取,相反zeta电位较高的NP-NH2较难被细胞摄取。所有纳米颗粒均表现出良好的生物相容性。课题组同时研究了不同的纳米颗粒在斑马鱼模型中的体内循环和生物分布(图4)。结果表明聚合物纳米颗粒的循环时间和生物分布取决于它们的物理尺寸。较小的纳米颗粒拥有更长的体内循环时间。对于特定的纳米颗粒尺寸,用COOH官能团修饰的带负电荷最多的纳米颗粒显示最长的循环时间,而带负电荷最少的NP-NH2的循环时间最短。
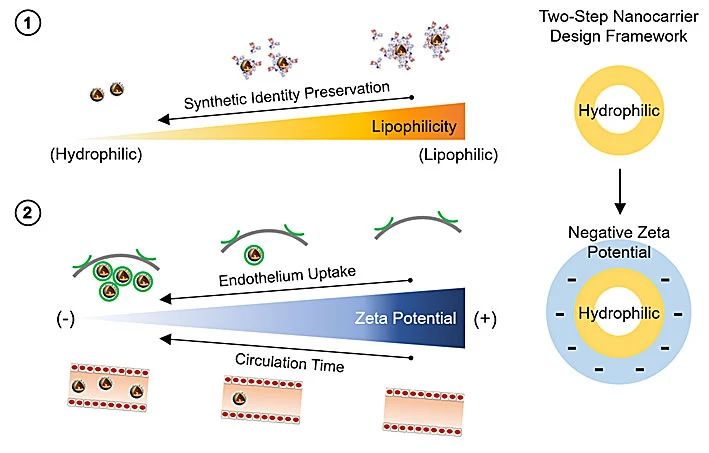
图5.利用亲脂性和Zeta电位的两步纳米载体设计框架示意
根据以上研究,课题组提出了一个两步设计框架(图5),用于制备具有所需的体外和体内生物学行为的聚合物纳米颗粒。首先,纳米载体设计应尽可能亲水,以最大程度地减少非特异性生物分子吸附并保持其性能。接下来,应提供亲水纳米载体较负的zeta电势,以增强其细胞摄取和体内循环时间,从而达到更好的成像和治疗效果。
来源:ACS PublicationsACS美国化学会
英文原题:Mechanistic Understanding of the Biological Responses to Polymeric Nanoparticles
