75年前,Luria和Delbrück证明细菌对噬菌体的抗性来源于随机突变,而这种随机突变在没有选择压力时就已经自发存在【1】。传统观点认为,肿瘤对靶向治疗产生抵抗也是因为“既成事实(fait accompli)”,即在治疗之前,抗药性突变的亚克隆就已经存在于任何可检测到的转移病灶中,这导致肿瘤的复发【2】。复发的时间仅仅是预先存在的少量耐药性突变细胞重新生长形成病灶所需要的时间间隔。另一种观点认为,靶向治疗的耐药性也可以通过治疗过程短暂增加基因组不稳定性,产生新的突变而获得。类似的过程已经发生在微生物加速产生抗生素抵抗突变【3】。稳定的微环境中,微生物的突变速率通常很低,防止有害突变的积累;但在细菌和酵母菌中,已经发现几种应激诱导遗传不稳定性及突变增加的机制,即应激诱导突变。
细菌中的持留菌通过降低生长速度可以在抗生素暴露导致的致死性应激条件下存活。DNA错配修复(MMR)效率随后降低,DNA聚合酶倾向于易出错型,这些加快存活菌群发生适应性突变的速率【4】。然后,选择压力允许能够在压力条件下复制的突变克隆进行生长。一旦受到应激的菌群适应了新的环境,高突变状态就被抑制,以避免有害突变的积累,防止突变负荷的持续增加。这些过程共同促进了遗传的多样性,帮助适应新的环境,并有助于抗性的获得。近期的研究表明,耐药性突变的肿瘤细胞不仅来源于稀有的、预先存在的突变克隆,也来源于耐药性亚群。对于癌症,耐药性持留细胞群的出现通常发生在癌基因依赖的肿瘤细胞接受靶向药物治疗。持留肿瘤细胞在靶向治疗中存活的机制目前尚不清楚。
近日,来自意大利的Alberto Bardelli在Science杂志发表文章Adaptive mutability of colorectal cancers in response to targeted therapies,报道了抗药性(持留)肿瘤细胞中,EGFR/BRAF抑制剂处理能够下调错配修复(MMR)、同源重组(HR)DNA修复基因,同时上调易错性聚合酶;诱导DNA损伤,增加突变,并触发微卫星不稳定性。此外,在治疗过程中,MMR蛋白在病人来源的异种移植物和肿瘤标本中下调。研究揭示了肿瘤细胞通过增加突变性能来逃避治疗压力。
研究人员选取微卫星稳定(MSS)的人结直肠癌细胞系DiFi(RAS和BRAF野生型,对EGFR抑制剂敏感)和WiDr(携带BRAF p.V600E突变,对EGFR+BRAF抑制剂敏感)为研究对象。靶向药物处理导致肿瘤细胞停留在G1细胞周期。然而,药物处理几周后,仍有小部分抗药性持留细胞存活;一旦移除药物选择压力,持留细胞恢复生长,并对靶向治疗保留敏感性,这表明持留细胞只是暂时地可逆性地对治疗抵抗。但是长期的药物治疗导致永久抗药性细胞的产生,移除药物压力也不能重新获得对药物的敏感性。
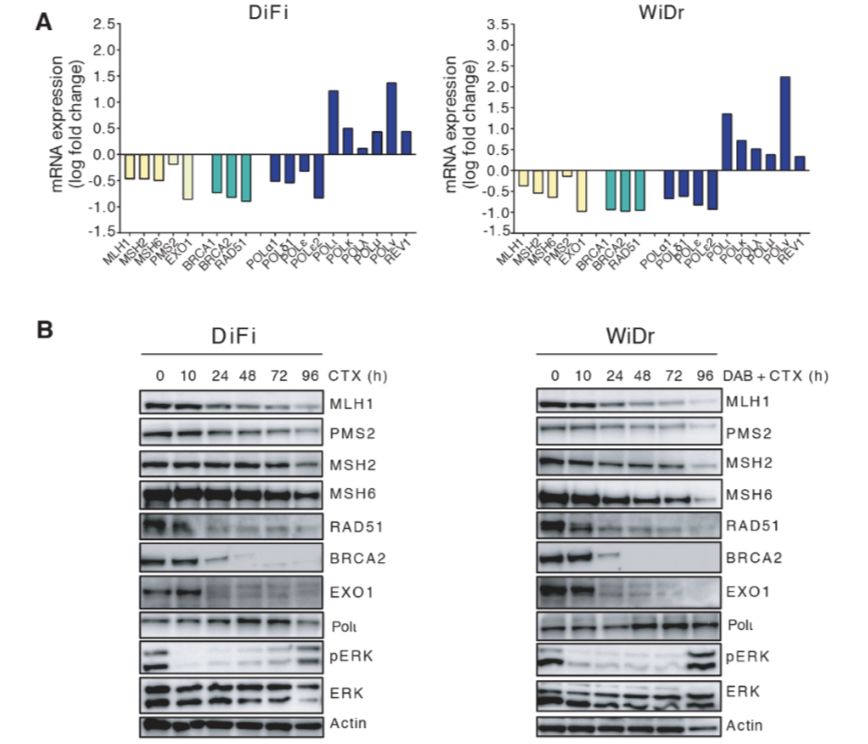
转录组分析显示,药物处理导致肿瘤细胞下调MMR基因MLH1、MDH2、MSH6,同源重组效应蛋白编码基因BRCA2、RAD51等,及参与错配修复和双链断裂修复的外切酶EXO1。但是这种靶向药物对DNA修复基因表达的调控只是暂时的,一旦移除药物压力,其基因表达水平就恢复到正常水平。药物处理导致MMR、HR蛋白的下调,从而导致错配修复效率(MMRp)、同源重组修复效率降低。使用6种微卫星稳定的病人来源的CRC建立异种移植物模型,其中CRC基因型为野生型KRAS、NRAS、BARF,EGFR抑制剂cetuximab能够导致不同程度地肿瘤消退。当cetuximab发挥最大效果时仍存在着持留细胞,相比于安慰剂对照组,肿瘤样本中MLH1、MSH2下调;病人样本中,相比于治疗前,靶向治疗响应后肿瘤组织中MLH1、MSH2下调。此外,靶向药物治疗导致肿瘤细胞中DNA聚合酶从高保真向低保真转换,即高保真性的POLδ和POLε下调,而准确度较低的POLι、POLκ和Rev1上调。易错性聚合酶通过引入错误,帮助DNA复制过程越过DNA损伤部位,这将导致碱基错配、DNA引物末端的掺入和突变率的增加。研究发现,靶向药物处理导致DNA损伤增加,伴随着ROS水平的显著增加。使用抗氧化剂NAC能够部分降低DNA损伤的形成,但不能抑制DNA修复基因的下调。
靶向药物导致的适应性突变的分子机制是什么?细菌中DNA损伤激活的SOS反应和通常的应激反应都能够诱导适应性突变。对哺乳动物细胞应激反应的主要调控因子mTOR进行检测,发现靶向药物处理导致mTOR效应分子pS6K-p70K下调,mTOR敲除对DNA修复蛋白、DNA损伤没有影响;但是,敲低癌基因(细胞特异性缺陷癌症驱动基因,即DiFi中敲低EGFR或KRAS,WiDr中敲低BRAF)能够降低DNA损伤蛋白表达、DNA损伤并导致mTOR下调,ROS水平上调。
最后,研究人员构建了CA-NanoLuc检测系统,能够高效率地检测肿瘤细胞中MMR状态。靶向药物导致的MMR短暂性下调导致DNA错配修复的失活。全基因组测序(WES)分析发现,持留细胞、药物永久抗性细胞的整体突变负荷仅有一小部分被影响,但是其微卫星区域的遗传不稳定性增加、微卫星区域的长度增加。
总的来说,研究揭示了肿瘤细胞通过发生适应性突变应对靶向治疗,逃避药物选择压力,为肿瘤抗药性及肿瘤复发提供了新的解释,提醒我们肿瘤治疗方案的制定需要考虑适应性突变的发生。
原文链接:https://science.sciencemag.org/content/early/2019/11/06/science.aav4474
参考文献
1. S. E. Luria, M. Delbrück, Mutations of bacteria fromvirus sensitivity to virus resistance. Genetics 28, 491–511 (1943)
2. S. Misale, R. Yaeger, S. Hobor, E. Scala, M.Janakiraman, D. Liska, E. Valtorta, R. Schiavo, M. Buscarino, G. Siravegna, K.Bencardino, A. Cercek, C.-T. Chen, S. Veronese, C. Zanon, A. Sartore-Bianchi,M. Gambacorta, M. Gallicchio, E. Vakiani, V. Boscaro, E. Medico, M. Weiser, S.Siena, F. Di Nicolantonio, D. Solit, A. Bardelli, Emergence of KRAS mutationsand acquired resistance to anti-EGFR therapy in colorectal cancer. Nature 486,532–536 (2012).
3. H. Long, S. F. Miller, C. Strauss, C. Zhao, L. Cheng,Z. Ye, K. Griffin, R. Te, H. Lee, C.- C. Chen, M. Lynch, Antibiotic treatmentenhances the genome-wide mutation rate of target cells. Proc. Natl. Acad. Sci.U.S.A. 113, E2498–E2505 (2016).
4. R. S. Galhardo, P. J. Hastings, S. M. Rosenberg,Mutation as a stress response and the regulation of evolvability. Crit. Rev.Biochem. Mol. Biol. 42, 399–435 (2007).
